诺达思团队在医疗器械人因工程测试方面,采用创新型测评工具,可提供包括人因设计需求分析 ( 进行用户研究、收集用户需求)、人因设计验证(尽早发现使用错误、评估风险 ) 和人因设计确认 , 最终输出人因设计研究及使用错误评估报告 。
测试评估主要工具
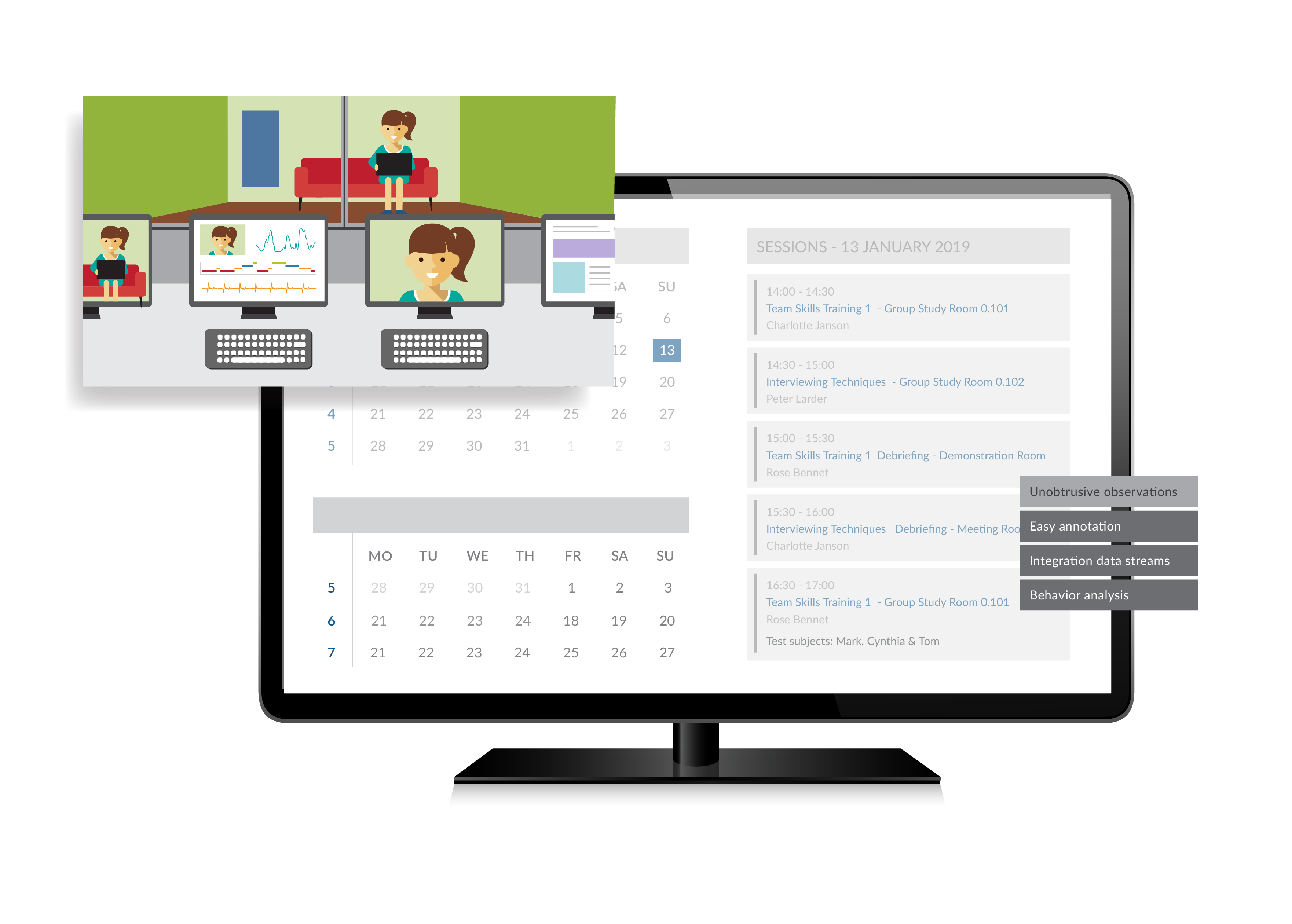
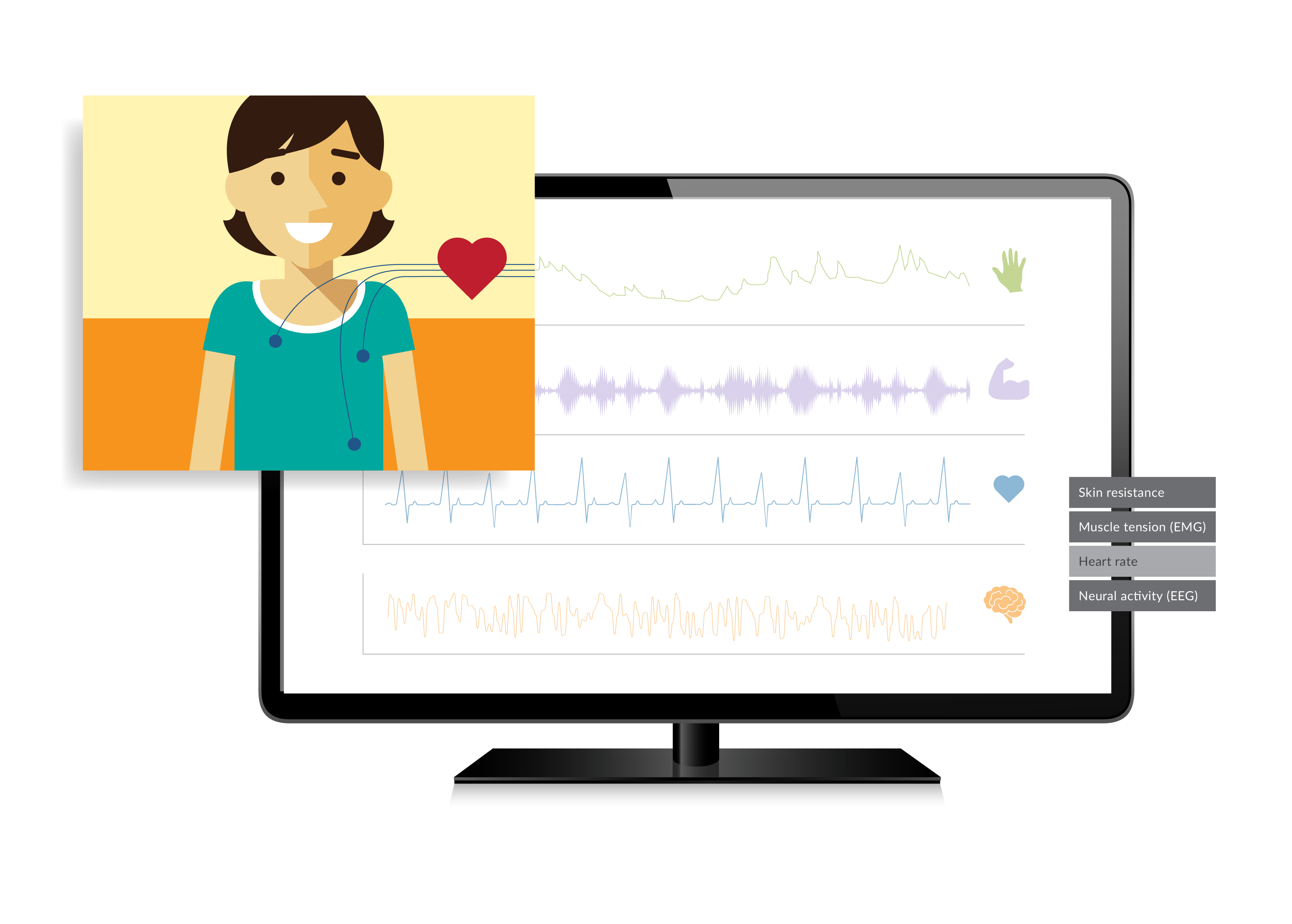
为了记录医疗器械人因工程测试的过程和相关的数据,以便测试中和测试后访谈提问,以及测试后分析测试结果,我们需要采用合适的测试工具。这样可以提高我们的测试效率,并为监管机构提供真实可复查的数据,文字,图像,和音视频材料。人因工程测试工具主要包括手指轨迹跟踪系统(Finger Tracking)及以下相关工具:
人因工程测试的必要性
1、法规要求:欧盟、美国、中国的医疗器械管理机构制定了人因设计相关的法律标准和指导原则: 要求二、三类医疗器械的生产企业或厂家在上市前必须进行人因设计评估并提交人因设计及使用错误评估报告;
2、提高开发效率和产品满意度:人因设计强调试错式开发, 通过快速迭代方式确定最小使用风险的方案能够减少开发成本, 提高产品开发效率,增强用户体验, 提高用户满意度。
3、提高品牌形象:早期的人因设计流程能够帮助企业发现潜在风险, 降低医疗事故, 企业责任感和形象也得以提高。
因此,需要愈加提高对于医疗器械的安全性和有效性的要求,尤其是由于用户界面设计缺陷导致的使用问题。为此各国相继出台了法规和标准要求医疗器械生产厂商开展可用性工程,确保设计出来的用户界面满足用户需求,保障器械的安全有效使用。
人因工程测试流程的建立
不论是国家药品监督管理总局的《医疗器械人因设计技术审查指导原则》,还是美国药品管理局FDA《人因工程应用于医疗器械指南》,以及欧盟《IEC 62366-1可用性工程在医疗器械中应用》,都要求医疗器械研发生产企业需要在产品开发设计工作中,建立医疗器械人因工程流程,记录产品开发整个过程中的人因工程的证据,形成文字档案,以便后期审核。
因此无论是在开发新产品,还是更新升级已有产品,无论离产品的最终设计定型阶段有多远,我们都可以从可用性、安全有效的角度,为您提供专业建议,以确保在用户界面设计时,充分考虑了预期用户和预期使用环境等因素,可以向监管审查机构提供足够的的书面证据资料。可以通过对产品或产品文档进行独立审查,了解产品开发过程是否遵循了人因工程和风险管理指南所要求的可追溯性。通过这样的审查,可以让您更加确信提交该产品的注册申请会成功。通过产品(文档)审查,我们可以指出产品设计哪里需要改进,或者产品文档哪里缺乏资料需要补充。
通过审查产品设计过程,可以按照监管审查员的期望以及人因工程标准和法规的要求,我们可以判断该产品开发的安全可用性方面是否符合要求。通过培训贵公司的工程师、质量管理人员、风险管理人员来帮助您将良好的人因工程和可用性风险管理流程嵌入到您的研发和生产制造组织中,可以帮助编写流程和模板文档,将良好的人因工程融入您的流程。
人因工程测试的三大部分

医疗器械使用风险是医疗器械风险管理的重要组成部分,故医疗器械使用风险级别可通过风险管理进行判定,但应在采取风险控制措施之前进行判定。医疗器械人因工程是医疗器械风险管理的重要一环,应结合用户、使用场景和用户接口开展风险管理,采用失效模式与效应分析(FMEA)、故障树分析(FTA)等风险分析方法,通过用户接口设计、防护措施、安全信息等风险控制措施将医疗器械使用风险降至可接受水平。
医疗器械使用风险评估,是人因工程工作的起点,是通过确认产品用户界面设计,识别潜在的和已有的使用错误,操作险肇,操作困难等,分析其根本性原因,找到改进的办法。不断迭代的设计更新改进,最终定型确认。因此开展充分的使用分析评估至关重要,鉴于目前国内的现实,我们可以提供相应的协助,完善使用风险的评估,为后期的确认性评估做好准备。
形成性评估在产品定型前开展的验证性研究,在产品迭代过程中不断的发现设计缺陷造成的使用错误,并改进相应设备接口界面的改进和完善,因此它应涵盖在产品设计和开发的全过程中。
通过形成性可用性评估我们更加了解产品或软件的安全性,明白产品的优劣势,为最终总结性可用性评估提供依据。FDA、CE 和其他公告机构也希望我们提供形成性评估的数据资料和结果,以便了解如何通过形成性评估来改进产品设计的。
通过与产品设计师和人因工程师一起选择合适而有效的形成性验证评估方式,如用户观察、专家走查,可用性测试等,并一起开展试验设计、规划,执行,和报告工作。


人因工程总结性测试是对产品最终版本进行的正式确认性研究。该研究必须按照 FDA《人因工程应用于医疗器械指南》,欧盟《IEC 62366-1可用性工程在医疗器械中应用》,中国《医疗器械人因设计技术审查指导原则》的要求,评估该产品使用风险的是否完全可接受。在理想情况下,人因工程总结性评估,最初就以一种适合所有监管机构要求的方式来设计和实施,确保通过该评估形成的证据,使用的术语是符合不同地区法规和指南的要求(例如 CE、FDA 和中国)。
虽然美国和中国的监管当局都要求需要在当地开展人因工程总结性验证测试工作,需要按照当地规定的格式提供报告,但若提前规划,前期获得的风险评估和人因工程评估证据和资料,仍然可以为最终报告的撰写提供强有力的支持。这样可以节约很多时间和资源,来满足不同国家的监管机构的要求,也方便将这些人因工程证据资料改写成不同监管机构要求的格式,向FDA、IEC,和NMPA出具专业级人因工程及可用性评估报告。
不知道怎么进行人因工程测试?
获取人因工程测试方案及流程